基礎研究
膵・胆道癌の発生・進展における遺伝子とその調節異常の意義および新規治療概念の探索
一言でいうと、がんは遺伝子(ゲノムDNA)の異常によって起こる病気です。これまでに、数多くのがん遺伝子(がん化を引き起こす遺伝子変異)や、がん抑制遺伝子の異常が見つかってきました。しかしながら、遺伝子変異そのものを治療対象とすることは難しく、有効な治療法の開発にはなかなか至っていないのが現状です。特に膵・胆道癌では、その原因のほとんどがKRAS遺伝子(がん原遺伝子の一つ)の変異であることがわかっていながら、未だに最難治癌であり続けています。このことは、遺伝子変異そのものを治療標的とすることがいかに難しいかということの、何よりの証拠といえます。
近年、がん細胞においてはゲノムDNAそのものの異常(遺伝子変異)だけではなく、DNAを取り巻く物質の立体構造・化学修飾も正常細胞と大きく異なることが明らかとなってきました。ゲノムDNAの“後”(エピ)に生じる変化、ということで、総称してエピジェネティクスと呼ばれるこうした変化は、基本的には可逆的な化学反応であることが最大の特徴です。もし、がん細胞において生じた異常なエピジェネティック変化のうち、がん細胞が生き延び、増殖するために必須のものがわかれば、これを正常な状態に修復することで、癌細胞を死滅させることができる可能性があります。
こうした背景から、私達の研究グループでは、膵・胆道癌ならびにひろく消化器癌におけるエピジェネティクスを研究しています。発がんに関わる変化から、がんそのものにおける変化までを、がん細胞、実験動物などを用いて広く研究することで、がんの新しい治療法を開発することを目的として、日夜研究に取り組んでいます。
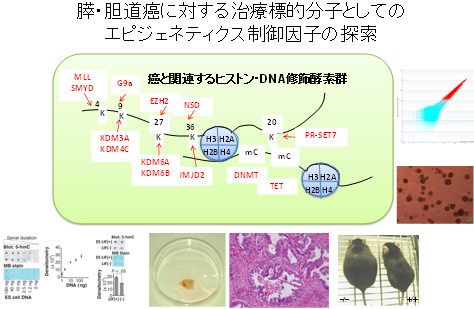 ヒト腫瘍組織、癌細胞株、遺伝子改変マウス、ゲノムワイドなエピゲノム解析系の活用
ヒト腫瘍組織、癌細胞株、遺伝子改変マウス、ゲノムワイドなエピゲノム解析系の活用
胆膵癌の発生と進展、新規治療法開発など
胆膵癌は、依然として最難治癌として厳然として存在し、かつその数は年々増加の一途を辿っています。この難治癌に挑むために、我々は、1つの柱として、遺伝子改変マウスの膵発癌モデルを用いた研究を行っています。これは、研究室の伊地知が米国留学中に樹立した膵臓特異的Kras活性化+TGF-beta II型受容体ノックアウトというモデルであり、ヒト膵癌の組織像をよく近似する間質の増生・線維化の著明な管状腺癌が全例に急速に発癌・進展し、約8週齢で死んでしまいます(図)(Ijichi et al., Genes Dev. 2006;20:3147)。
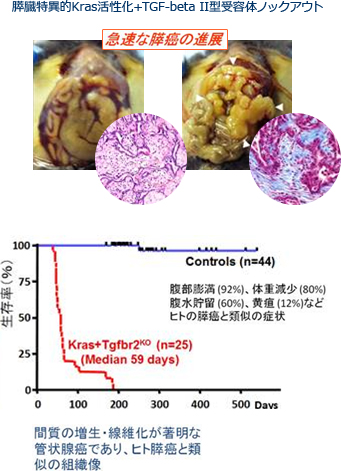
このモデルは非常に進行が速いので、新たな治療薬をマウスに投与し、その生存期間が延長するかどうかという評価を比較的短期間で行うことができます。そこから生存を延長する有効な治療法を選択し、その作用機序を詳細に解析し、そして実臨床につなげていくという基礎と臨床の連続的な展開を目指しています。特に間質が豊富で線維化の著明な膵癌においては、癌細胞のみでなく、癌細胞を取り巻く間質の影響を含めた癌の微小環境が疾患の成立および経過に重要と考えられ、個体に対する治療薬の効果は、癌の微小環境がインタクトである遺伝子改変発癌モデルを用いて評価することが望ましいと考えられるようになってきています。
そのような一例として、進行した膵癌に対するgemcitabine+ARB(アンギオテンシン受容体阻害剤)治療の自主臨床試験があります。ARBには、降圧作用のみでなく、臓器保護や血管新生阻害など様々な作用があることが知られており、癌に対する効果にも興味がもたれています。
実際にこの膵癌モデルにARB数種を投与したところ、いくつかのARBは血管新生阻害効果および線維化抑制効果を示し、gemcitabineとの併用で生存延長効果を示しました。また、過去に当科でgemcitabine治療を行った進行膵癌の患者さんの治療成績を解析すると、高血圧がありARBまたはACE阻害剤を併用していた群が、その他の降圧剤を併用していた群・降圧剤の併用のない群と比較して有意に良好な生存成績を示していました(Nakai et al., Br J Cancer 2010;103:1644)。これらの結果から、当科では、進行膵癌の患者さんに対するgemcitabine+ARBの併用療法の自主臨床試験を行いました(Nakai et al., Cancer Sci 2012;103:1489; Nakai et al., Invest New Drugs 2013 May 21 Epub ahead of print)。残念ながらこの治療方法が明らかに有効であるという結果は得られませんでしたが、局所進行例には有効である可能性があると思われました。これが我々の発癌モデルが臨床試験とつながった一例めです。これ以外にも、この発癌モデルにおいて、癌の微小環境・腫瘍間質相互作用を標的とした治療の有効性を示す結果が得られています(Ijichi et al., J Clin Invest 2011;121:4106; Takahashi et al., Cancer Sci 2013;104:337など)。
このモデルは、このような治療法の検討という最も臨床に近いスタンスの研究だけでなく、発癌機序・前癌病変と浸潤癌の関係の解明、早期診断法や生体マーカーの確立、膵癌の微小環境・腫瘍間質相互作用の研究、治療抵抗性出現機序の研究等、様々な研究のツールとなり、それを通じて膵癌の全過程をよりよく理解し、臨床に役立てていきたいと考えています。
一方、「From Bench to Bedside」のみならず、「From Bedside to Bench」という方向の研究も行っています。一例として、最近日本でも膵癌に対し使用できるようになった分子標的薬erlotinibについて、なぜ有効であったのかについてのメカニズムを、この膵発癌モデルにgemcitabineとerlotinibを投与し検討しました。その結果、gemcitabineを投与するとEGFR-MAPKというシグナルが著明に活性化し治療抵抗性の反応を示しており、erlotinibはKRAS変異の有無に関わらずこのEGFR-MAPKシグナルの活性化を阻害して効果を示しているということが分かりました(Miyabayashi et al., Cancer Res 2013;73:2221)。このように臨床からの疑問をモデルを用いて検証することもできます。
また、このモデルを利用して、更に新たな消化器癌モデルの作製も試みています。膵癌の発癌進展におけるいくつかの分子の重要性を探るために、その分子のノックアウトマウスと交配したり、膵臓だけに留まらず、肝臓や消化管特異的な遺伝子改変モデルを作製したりと、視野を広げた研究も進めています。
膵癌の発癌過程において発現する
ノンコーディングRNAの生物学的意義解明と臨床への応用
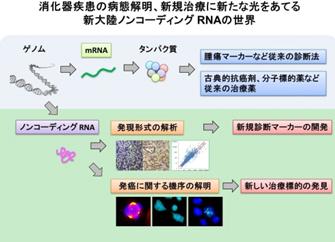
新規化学療法などの抗癌療法の開発、早期診断のための検査診断デバイスの技術革新が著しい現在においても、膵臓がんは根治の困難な難治性疾患として挙げられます。この現状を打破するためには、既存の概念にとらわれない新しい側面からのアプローチが重要と考えられます。
近年の遺伝子シークエンス技術のめざましい発達により、30億塩基対に及ぶヒトのゲノム配列が解明されるにつれて、遺伝情報の本質と考えられていたタンパク質をコードする領域は全体の数%にしかすぎないこと、それ以外のタンパク質をコードしない領域からも多くのRNAが産生されていることが分かってきました。これらタンパク質をコードしないノンコーディングRNAは全ての生物種において複雑な生命活動を微細に調節し維持ずる重要な因子であり、また、その機能の異常が疾患の発生進行にも深く関与していることが明らかにされつつあります。
我々は膵癌組織において著明に発現が亢進しているノンコーディングRNAの一種であるサテライトRNAに注目して研究を進めています。このRNAは正常な膵臓ではほとんど発現していないため、簡便かつ効率的な測定系を確立することによって新たな腫瘍早期診断マーカーとなり得る可能性を秘めていると考えています。また、サテライトRNAが発現することで細胞分裂の異常やDNA障害など発癌に深く関わる変化が細胞に生じることも見出しています。今後はその作用起点を明らかにするとともに、マウスモデルを用いて実際に発癌の促進や抑制に関与するかどうか検証を行う予定です。正常組織の遺伝子に異常が生じて発癌に至るまでのメカニズムを、ノンコーディングRNAという側面から解明し、新たなる治療法の開発へとつなげていきたいと考えています。
 ヒト腫瘍組織、癌細胞株、遺伝子改変マウス、ゲノムワイドなエピゲノム解析系の活用
ヒト腫瘍組織、癌細胞株、遺伝子改変マウス、ゲノムワイドなエピゲノム解析系の活用


